3.1 Mycobacterium bovis bij katten en mensen
In december 2022 werd Mycobacterium bovis vastgesteld bij een kitten van ruim drie maanden oud. De kitten was geëuthanaseerd op basis van ernstige luchtwegklachten en voor necropsie ingestuurd naar het Veterinair Pathologisch Diagnostisch Centrum (VPDC) in Utrecht. Het dier kwam uit een nestje van vier kittens waarvan twee eerder reeds waren overleden. Na het waarnemen van zuurvaste staven (Ziehl-Neelsen-kleuring) bij het histologisch onderzoek van long- en lymfeknoopmateriaal is via PCR de diagnose van een M. bovis-infectie gesteld. In de daaropvolgende maanden werden zowel de moederpoes van het nestje als twee andere volwassen katten uit hetzelfde huishouden geëuthanaseerd en aangeboden voor uitgebreid diagnostisch onderzoek. Twee van deze dieren vertoonden respiratoire verschijnselen, de derde kat werd geëuthanaseerd op basis van afwijkingen waargenomen bij röntgenonderzoek. Bij alle drie de katten werd met PCR de diagnose van een M. bovis-infectie gesteld.
De laatst overgebleven kitten en de hond uit het hierboven beschreven huishouden vertoonden geen ziekteverschijnselen. De röntgenfoto’s van deze dieren gaven aanleiding voor een langdurige antibioticabehandeling. Deze behandeling is opgevolgd met klinische controles en röntgenonderzoek. Diagnostiek bij levende gezelschapsdieren voor tuberculose is niet eenvoudig, de huidtest (Mantoux) en interferon-gamma release assay test (IGRA) zijn niet beschikbaar als betrouwbare methoden.
M. bovis wordt primair gezien bij runderen. Sinds 1999 heeft Nederland de officiële EU (Europese unie) vrij-status voor rundertuberculose, waardoor de ziekte nog slechts sporadisch voor komt (zie 2.3 Dierziekte-vrij status). M. bovis is niet erg diersoort specifiek; mensen en huisdieren zoals katten, fretten en honden kunnen ook besmet worden.
Alle katten in het huishouden zijn in Nederland gefokte dieren zonder diercontacten buiten het gezin. De hond werd gevoerd met rauw-vleesvoeding en de katten aten hier weleens van mee. Deze rauw-vleesvoeding wordt als meest waarschijnlijke bron van besmetting van de katten beschouwd. In Groot-Brittannië is in 2021 een uitbraak van M. bovis bij katten beschreven waar rauw vlees als mogelijke bron werd geïdentificeerd.1
De personen in contact met deze dieren zijn getest met een tuberculine-huidtest (Mantouxtest). Na een positieve reactie van de huidtest is, onder begeleiding van een tuberculosearts van de regionale GGD (Gemeentelijke gezondheidsdiensten), een Interferon Gamma Release Assay (IGRA-test) uitgevoerd. Bij meerdere personen uit het gezin is op deze manier een besmetting met tuberculose vastgesteld. Onder de onderzochte, minder intensieve, contacten (Ring 2) zijn geen tuberculose besmettingen gevonden. Overdracht van M. bovis van katten naar de mens is eerder beschreven in een casus uit het Verenigd Koninkrijk.2 Naar aanleiding van deze gevallen is er in Groot-Brittannië een risico-inventarisatie uitgevoerd, waarbij het risico van overdracht van katten naar de mens als zeer laag werd ingeschat.3
Enkele maanden later werd wederom een M. bovis-infectie aangetoond bij een geëuthanaseerde jonge kat ingestuurd voor necropsie naar het VPDC (casus 2). Er was geen connectie met het huishouden van de eerste casus. Wel wees ook hier het bron- en contactonderzoek in de richting van rauw-vleesvoeding. Er is contact gezocht met de fokker waar deze kat vandaan kwam en röntgenonderzoek uitgevoerd bij andere katten bij deze fokker en katten uit hetzelfde nest als de besmette jonge kat. Bij geen van deze dieren werden afwijkingen gevonden.
NVWA (Nederlandse Voedsel- en Warenautoriteit) heeft brononderzoek uitgevoerd naar de herkomst van de rauw-vleesvoeding van beide huishoudens. Tracering gaf diverse bedrijven en groohandels in BE en NL waarlangs producten gegaan zijn en in dierenwinkel (casus1) en een supermarkt (casus2) terecht zijn gekomen. De besmetting van de dieren heeft mogelijk al in de zomer van 2022 plaatsgevonden. De in deze periode gevoerde partijen rauw-vleesvoeding waren niet meer beschikbaar en het was dan ook niet mogelijk deze te onderzoeken op de aanwezigheid van M. bovis.
Bij de katten uit beide huishoudens is de diagnose van een infectie met M. bovis bevestigd door middel van kweek. Deze M. bovis isolaten zijn gesequenced en de genetische profielen zijn met elkaar vergeleken. Opvallend genoeg bleek er sprake van twee verschillende types M. bovis. Uit een beschikbaar humaan longbiopt van huishouden 1 kon geen M. bovis worden gekweekt, echter werd wel DNA van M. bovis aangetoond. Daarnaast waren specifieke SNPs van M. bovis katten isolaten uit huishouden 1 aanwezig, welke niet voorkomen in M. bovis katten isolaten van huishouden 2, wat aannemelijk maakt dat transmissie binnen huishouden 1 heeft plaatsgevonden.
Eind maart 2023 is er een VetInf@ct verstuurd over deze casussen naar dierenartsen in Nederland. Dierenartsen werden verzocht om melding te maken bij de NVWA wanneer zij een huisdier (kat, fret, hond) treffen met respiratoire klachten, onbegrepen vermagering, koorts en/of lethargie en wanneer er sprake was van voeding met rauw vlees. Sinds het versturen van dit VetInf@ct zijn geen verdere met M. bovis besmette katten of andere huisdieren gevonden.
Tenslotte werd er in mei 2023 melding gemaakt van een humane patiënt met longtuberculose veroorzaakt door M. bovis. De persoon werkte in een bedrijf waar dierlijke bijproducten en rauw vlees van geschoten wild afkomstig uit Oost-Europese landen en Duitsland werd verwerkt in diervoeding. Bij het contactonderzoek zijn in de eerste ring (n=11) bij vier personen tuberculose infecties vastgesteld, waarvan 3 collega’s en één familielid. In de tweede ring (n=14), zijn geen tuberculose infecties gevonden. Een tuberculose infectie zonder ziekteverschijnselen wordt doorgaans preventief behandeld met een kuur van 3 maanden antibiotica, bij de ziekte tuberculose wordt 9 maanden met antibiotica behandeld. De sequentie van de M. bovis bacterie van deze humane patiënt bleek te verschillen van de twee types M. bovis die eerder bij katten gevonden zijn.
Literatuur:
- O’Halloran, C., et al., Feline tuberculosis caused by Mycobacterium bovis infection of domestic UK cats associated with feeding a commercial raw food diet. Transboundary and Emerging Diseases. 2021; 68:2308–2320
- O’Connor, C.M., et al., Cat-to-Human Transmission of Mycobacterium bovis, United Kingdom. Emerging Infectious Diseases. 2019; 25(12): 2284–2286
- Human Animal Infections and Risk Surveillance Group (HAIRS), Qualitative assessment of the risk that cats infected with Mycobacterium bovis present to human health. Public Health England, 2014
3.2 Tekenencefalitis (TBE)
3.2.1 Hoofdpunten
- In 2023 zijn in totaal 5 laboratorium-bevestigde humane TBEV infecties gemeld die een besmetting hebben opgelopen in Nederland, allen in nieuwe risicogebieden. Er waren verder geen meldingen in de virologische weekstaten.
3.2.2 Achtergrond
Tekenencefalitis is een hersen(vlies)ontsteking die veroorzaakt wordt door het tekenencefalitisvirus (TBEV), een orthoflavivirus. Het virus kan overgedragen worden door de schapenteek (Ixodes ricinus). De meeste mensen die besmet zijn met het virus worden niet ziek of ontwikkelen milde klachten. Bij mensen die wel ziek worden, kan de ziekte in twee fasen verlopen. In de eerste fase kunnen mensen griepverschijnselen, koorts en hoofdpijn ontwikkelen. Deze verschijnselen duren ongeveer vijf tot tien dagen. Een aantal dagen na afloop van de eerste fase kan er een tweede fase ontstaan met hoge koorts, hoofdpijn, verlammingsverschijnselen, ontsteking van de hersenen en hersenvlies. In uitzonderlijke gevallen kunnen mensen aan de infectie overlijden. Er is een vaccin beschikbaar tegen TBEV infecties.
3.2.3 TBE bij mensen
In Nederland bestaat geen meldingsplicht voor TBE. Wel kunnen laboratoria op vrijwillige basis TBE-patiënten melden bij het RIVM (Rijksinstituut voor Volksgezondheid en Milieu). In 2016 werden in Nederland de eerste autochtone humane TBE-patiënten gemeld. Sindsdien werden in Nederland TBE patiënten voornamelijk gediagnosticeerd in of nabij twee bekende locaties (de Sallandse en Utrechtse Heuvelrug), maar ook zijn patiënten gemeld vanuit andere locaties, namelijk centraal Noord-Brabant, het noordoosten van de Flevopolder, Twente, en de Achterhoek. In 2023 kwam daar Terschelling bij (zie kaart: Verspreiding TBE-vrius). In 2023 zijn in totaal 5 patiënten gemeld waarvan met zekerheid vastgesteld kon worden dat ze de besmetting hebben opgelopen in Nederland, waarvan 3 op Terschelling (waaronder 1 toerist uit het buitenland), 1 in Zandvoort, en 1 in Ermelo. Terschelling, Zandvoort en Ermelo zijn hiermee nieuwe risicogebieden. Het cumulatief aantal laboratorium-bevestigde autochtone TBE-infecties bedraagt 20 tot en met 2023 (21 incl. 1 toerist uit het buitenland).
3.2.4 TBE bij een paard
Eind augustus is er bij een paard met neurologische verschijnselen (ataxie) op Terschelling bloed afgenomen. In het kader van de syndroomsurveillance voor westnijlvirusinfecties werd het sample getest op WNV antilichamen. Het serum was positief in de WNV-competitie-ELISA (toont zowel IgG als IgM aan), maar testte negatief in een ELISA specifiek voor WNV IgM-antistoffen. Omdat serologische kruisreactie tussen verschillende nauwverwante flavivirussen een bekend fenomeen is, is het serum van het paard vervolgens met virus neutralisatietesten geanalyseerd bij WBVR (Wageningen Bioveterinary Research) en Erasmus MC. Het serum testte hierin negatief voor antilichamen tegen WNV en Usutu virus, maar positief voor antilichamen tegen TBEV. Het serum testte bovendien positief voor TBEV IgM bij ErasmusMC. De eigenaar van het paard herinnerde zich een tekenbeet in de periode voor de neurologische klachten. Het is beschreven dat IgM-ELISAs minder vaak tot kruisreactie leiden dan IgG ELISAs.1 Het paard is weer hersteld.
Dit is het eerste bekende geval van TBE bij een paard in Nederland. Wel zijn casussen van paarden met TBE virusinfecties beschreven elders in Europa, zoals Zwitserland.2
3.2.5 TBE in wilde knaagdieren en teken
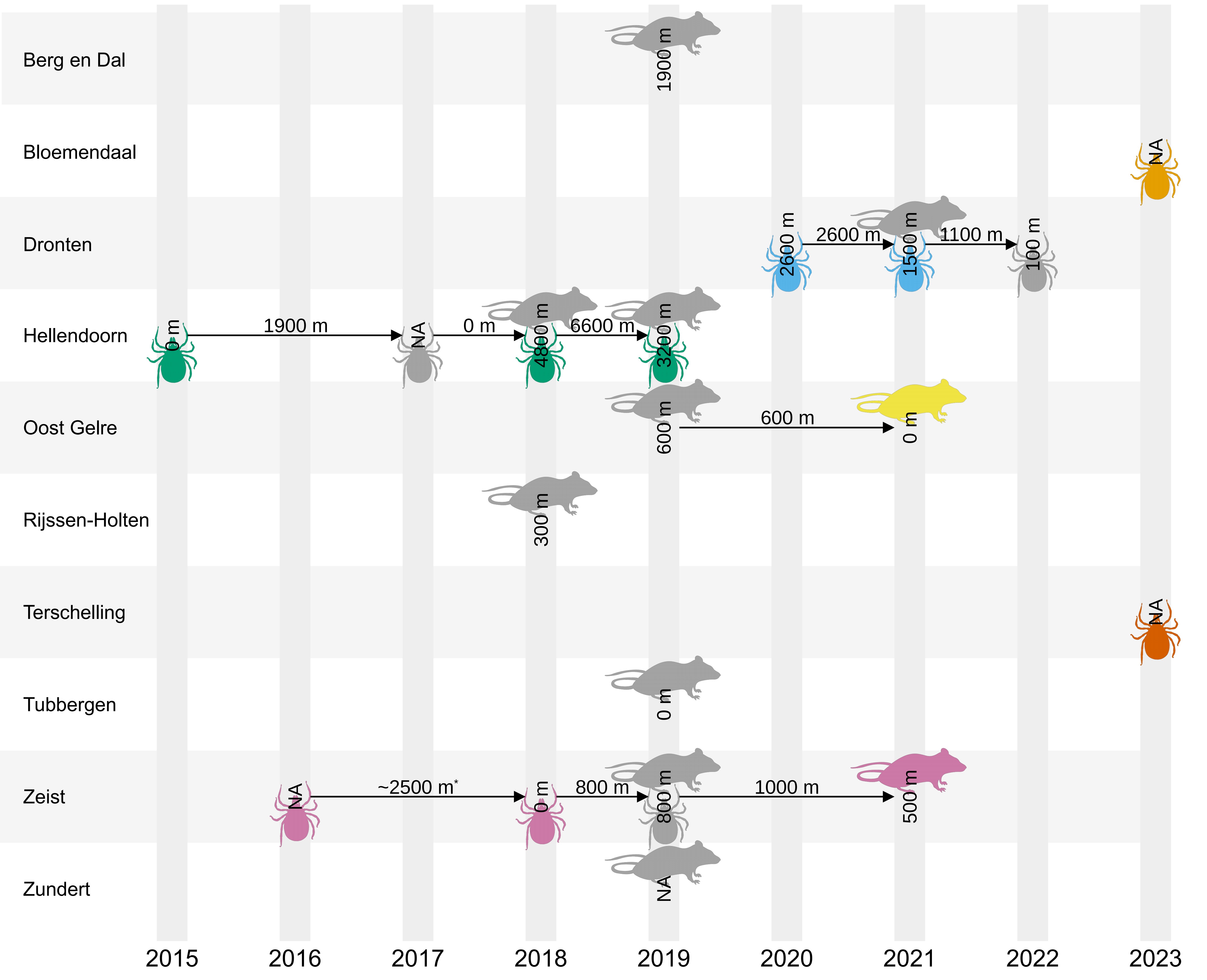
Het TBE virus is tot en met 2023 op zes verschillende locaties verspreid over Nederland in teken en/of knaagdieren aangetroffen, ook op twee van de plekken waar in 2023 patiënten vandaan kwamen (Terschelling en Zandvoort). Virussen van al deze locaties zijn gesequenced. Het is heel opvallend dat de virussequenties van de zes locaties in Nederland genetisch meer lijken op virussequenties uit het buitenland (bijvoorbeeld Zweden, Finland, Rusland en Oostenrijk), dan op elkaar. Het lijkt er dus op dat het TBE virus op al deze plekken is geïntroduceerd vanuit het buitenland, waarschijnlijk via (teken op) trekvogels. Langjarig onderzoek laat zien dat TBEV zich op de meeste plekken lokaal vestigt en verspreidt (Figuur 3.2.1). Doordat het virus waarschijnlijk via trekvogels wordt geïntroduceerd, is het heel lastig te voorspellen hoe wijd verspreid het virus voorkomt in Nederland en waar het virus (opnieuw) kan opduiken. Het onverwacht opduiken van patiënten in Terschelling (2022 en 2023), Ermelo (2023) en Zandvoort (2023) bevestigt dat.
Figuur 3.2.1 Weergave van de verschillende locaties waar en wanneer in Nederland het TBE virus is aangetoond in teken en/of knaagdieren in de jaren 2015-2023. Afstanden geven aan hoeveel meter er ligt tussen de punten waarop de positieve teken en/of knaagdieren zijn gevonden. NA = slechts op één punt positieve teken en/of knaagdieren gevonden.
3.2.6 Preparedness en respons
Het RIVM en (vele) andere organisaties geven veelvuldig en regelmatig voorlichting over teken en Lymeziekte. De adviezen in deze voorlichting om tekenbeten te voorkomen, helpen natuurlijk ook tegen TBE.
Artsen, en met name neurologen en infectiologen, moet er rekening mee houden dat op TBE overal in Nederland kan opduiken, en deze ziekte meenemen in hun differentiaal diagnose bij mensen met passende (neurologische) klachten.
Literatuur:
- Beck, C., et al, Improved reliability of serological tools for the diagnosis of West Nile fever in horses within Europe. PLoS Neglected Tropical Diseases. 2017; 11(9): e0005936
- Magouras, I., et al, Neurological disease suspected to be caused by tick-borne encephalitis virus infection in 6 horses in Switzerland. Journal of Veterinary Internal Medicine. 2022; 36(6):2254-2262
3.3 Varkensinfluenza: resultaten van de surveillance pilot (2022-2023) bij varkens vanuit een One Health perspectief
In 2022 zijn het RIVM (Rijksinstituut voor Volksgezondheid en Milieu), Royal GD (Gezondheidsdienst voor Dieren), WBVR (Wageningen Bioveterinary Research) en Erasmus MC een pilot gestart om in samenwerking met varkensdierenartsen influenzavirussen op varkensbedrijven te verzamelen en te karakteriseren. Het doel van deze monitoring was om deze virussen te karakteriseren en op sequentie niveau te vergelijken met relevante influenzavirussen van mensen vanuit een One Health perspectief. Met de resultaten van deze pilot zal ook bepaald worden hoe een continu surveillanceprogramma bij varkens kan worden opgezet. De opzet van een gezamenlijk moleculair platform, een online database, maakte ook deel uit van deze pilot.
Tijdens de pilot, uitgevoerd in de periode 2022-2023, zijn in totaal 825 monsters (speeksel en neusswabs) verzameld van varkens met klinische verschijnselen die afkomstig waren van 90 verschillende varkensbedrijven. Deze monsters zijn aangevuld met 75 influenzavirus-positieve monsters uit de routine monsterstroom van GD. Van de speekselmonsters bleek 58% PCR-positief voor influenza virus, terwijl van de neusswabs 29% positief was. Van de 90 bemonsterde bedrijven bleek op 78% tenminste één monster positief.
Uit deze positieve monsters werden in totaal 129 virussequenties verkregen. Hiervan waren er 74 van het H1N1, 51 van het H1N2 en 1 van het H3N2 subtype. De 124 H1 stammen behoorden tot 4 verschillende genetische lijnen (lineages): Classical Swine lineage (CS; clade 1A.3.3.2), de Eurasian Avian lineage (EA; clade 1C.2.1 en clade 1C.2.2) en de Human Seasonal lineage (HS; clade 1B.1.2.1). Het gedetecteerde H3N2 virus bleek nauw verwant aan varkensvirussen die in de periode 2015-2016 in Duitsland circuleerden. Er zijn geen aviaire influenza A virussen (e.g., H5Nx) gevonden tijdens deze pilot. Uit de analyse van de sequenties bleek verder dat de virusdiversiteit binnen deze varkensstammen groter was dan die momenteel bij mensen is. Twee virussequenties, afkomstig van één bedrijf, clusterden met humane virussen. Dit suggereert dat er een besmetting van een varken heeft plaatsgevonden met een humaan H1N1 virus, met vervolgens overdracht tussen varkens.
Van een selectie geïsoleerde virussen (n=32) is de gevoeligheid voor antivirale middelen bepaald. Er was, ondanks significante verschillen met humane virussen, geen verlaagde gevoeligheid voor de neuraminidaseremmers gevonden in de varkensvirusstammen.
Daarnaast zijn 28 virussen antigeen gekarakteriseerd. Dit is belangrijk om te begrijpen in hoeverre vaccinatie of eerdere infectie bescherming biedt tegen de onderzochte virussen. De Classical Swine en Human Seasonal lineage virussen afkomstig van varkens vertoonden nauwelijks reactiviteit met beschikbare frettensera in de HAR-test (Haemagglutinatie remmingstest). Dit betekent dat de in de pilot gevonden virussen veel verschilden van de sera waar tegen ze getest werden. De Eurasian Avian lineage virussen werden wel herkend door frettensera dat is opgewekt tegen oudere virussen van clade 1C.
Infecties van mensen met varkensinfluenzavirussen komen sporadisch voor, in Nederland zijn uit de afgelopen 10 jaar vijf gevallen bekend. Tijdens de pilot zijn er twee humane casussen met een varkensinfluenza infectie (in 2022 (H1N2) en 2023 (H1N1)) gevonden in de reguliere humane influenzavirus surveillance waarvan de sequenties identiek of zeer vergelijkbaar waren aan sequenties uit varkens
De resultaten van deze pilot surveillance heeft inzicht opgeleverd welke virussen circuleren bij varkens, en is dan ook behulpzaam voor een snelle duiding van de humane casussen en is ook informatief voor de varkenssector. Met de opgedane ervaring in deze pilot zal in 2024 de surveillance worden voortgezet en daarnaast zullen ook wilde zwijnen en buitenuitloop varkens worden onderzocht op influenza virussen.
Literatuur:
1. Meijer, A., et al, Rapportage pilot Varkensinfluenza surveillance, RIVM rapport 2023-0443
Auteurs: Adam Meijer, Dirk Eggink, Annelies Kroneman, Ron Fouchier, Manon Houben, Erhard van der Vries, Evelien Germeraad, Joke van der Giessen3.4 4 Salmonella Enteritidis verheffing in 2023
Sinds juni 2023 was er een landelijke uitbraak van infecties met Salmonella Enteritidis (Figuur 3.4.1), een van de grootste bekende uitbraken in Nederland ooit. De piek in het aantal infecties werd gezien in week 37 (september) van 2023, waarna het aantal patiënten geleidelijk afnam tot het einde van het jaar. Echter, na bijna drie maanden zonder nieuwe patiënten binnen dit cluster, werden er tussen mei en juli 2024 opnieuw enkele nieuwe patiënten geïdentificeerd. Op 10 september 2024 waren er in totaal 171 patiënten geïdentificeerd, waarvan 151 in 2023 en 20 in 2024. Van hen was 85 man en 86 vrouw. Dit betreft laboratorium-bevestigde patiënten. Doordat niet alle infecties gediagnosticeerd of gerapporteerd worden ligt het werkelijke aantal symptomatische infecties naar schatting een factor 20 hoger.
De Nederlandse Voedsel- en Warenautoriteit (NVWA), het Controle Orgaan voor Kwaliteits Zaken (COKZ) en het RIVM (Rijksinstituut voor Volksgezondheid en Milieu) voerden gezamenlijk een landelijk onderzoek uit naar de bron van de uitbraak. Het cluster werd geïdentificeerd met gebruik van Whole Genome Sequencing (WGS), waarbij het erop leek dat patiënten mogelijk deel uitmaakten van twee genetisch sterk verwante clusters met respectievelijk 117 en 54 patiënten. De leeftijdsspreiding varieerde van 1 tot 98 jaar (25e percentiel: 19; 50e percentiel: 40.5; 75e percentiel: 66 jaar). Van de isolaten waren er 153 afkomstig van fecesmonsters, 11 van bloedkweekmateriaal, en 5 van overige materialen.
3.4.1 Epidemiologisch onderzoek
Het vragenlijstonderzoek bevestigde het vermoeden van twee verschillende clusters: één cluster bleek voornamelijk gerelateerd aan de consumptie van scharreleieren, terwijl het andere cluster verband hield met biologische eieren. De vragenlijst richtte zich daarom al snel op het verkrijgen van informatie met betrekking tot het type ei, de herkomst, de ei-codes, en of de eieren nog beschikbaar waren voor microbiologisch onderzoek door de NVWA (Nederlandse Voedsel- en Warenautoriteit). Deze aanpassingen leverden echter weinig informatie op, omdat de meeste mensen de eieren al hadden geconsumeerd.
3.4.2 Traceringsonderzoek en handhaving
Uit de tracering van de NVWA en het COKZ bleek dat meerdere factoren een rol speelden in deze uitbraak. Volgens de geldende regelgeving mogen eieren afkomstig van met Salmonella besmette stallen niet verkocht worden voor directe consumptie. In plaats daarvan moeten deze eieren verplicht worden geleverd aan de voedingsmiddelenindustrie, waar ze een extra verhittingsproces ondergaan om het pathogeen te elimineren.
Op basis van WGS bleek dat Salmonella-isolaten van veertien verschillende legbedrijven genetisch gerelateerd waren aan de uitbraak. Dit duidde erop dat de uitbraak meerdere bronnen had. Een belangrijke doorbraak kwam toen vier Salmonella-isolaten van gedroogde eierschalen, afkomstig van zowel eierschaalverwerkingsbedrijven als diervoederproducenten, tot het uitbraakcluster bleken te behoren. Deze eierschalen werden verwerkt als calciumbron in pluimveevoer.
Nader toezicht op de diervoederketen door de NVWA wees op een tekortkoming in de bewerking van eierschalen, waardoor Salmonella niet effectief werd geëlimineerd en besmette eierschalen terecht konden komen in pluimveevoer. Dit kon verklaren waarom meerdere leghenbedrijven besmet waren met een genetisch gelijkende stam. De sectorpartijen in de eier- en diervoederketen werden op de hoogte gesteld van de bevindingen en hebben maatregelen genomen om de hygiëne te verbeteren en verdere besmettingen te voorkomen, waaronder aanscherping van het verhittingsproces en strengere controle op kruisbesmetting. De NVWA en COKZ zien toe op deze maatregelen. Deze maatregelen lijken effectief te zijn geweest, waardoor de uitbraak sinds juli 2024 ten einde is. Er bestaat nog wel de mogelijkheid dat er nog enkele patiënten geïdentificeerd worden omdat de uitbraakstam nog aanwezig kan zijn op nog niet geïdentificeerde locaties. Nieuwe patiënten zullen niet meer geïnterviewd worden, omdat de vragenlijstdata van de meest recente patiënten geen nieuwe inzichten gaven.
3.4.3 Samenvatting
De uitbraak van Salmonella Enteritidis in 2023 werd waarschijnlijk veroorzaakt door besmette eierschalen die in pluimveevoer werden verwerkt. Onvoldoende behandeling van deze eierschalen bracht systemische kwetsbaarheden in de voedselveiligheidsketen aan het licht. Dankzij de intensieve samenwerking tussen het RIVM, de NVWA, het COKZ, Wageningen Food Safety Research (WFSR) en Wageningen Bioveterinary Research (WBVR) kon de vermoedelijke bron worden opgespoord. WGS speelde een cruciale rol bij het identificeren van genetische clusters en het traceren van besmettingsroutes. De WGS-analyses, in combinatie met het vragenlijstonderzoek, toonde aan dat de uitbraak bestond uit twee clusters die beide verband hielden met verschillende soorten eieren, besmet via dezelfde route. De genomen maatregelen, waaronder verbeterde hygiëneprocedures, het aanscherpen van de verwerking van eierschalen en strengere controles op grondstoffen voor diervoeder, hebben effectief bijgedragen aan het beëindigen van de uitbraak.
Auteurs: Dana Adriaansen, Oda van den Berg, Ife Slegers-Fitz-James, Mark van Dommelen, Jenny Batstra, Karin Nagel, Maaike van den Beld, Maren Lanzl, Kim van der Zwaluw, Diederick Brandwagt, Angela van Hoek, Kirsten Mooijman, Eelco Franz, Coen van der Weijden, Roan Pijnacker
Figuur 3.4.1 Aantal Salmonella Enteritidis-patiënten gerelateerd aan de uitbraak op basis van WGS, naar week van (geschatte) eerste ziektedag, juni 2023-juli 2024